Dosis fija
INAQOVI es un AHM oral de dosis fija1, no es necesaria una dosificación ajustada al peso.

Exposición sistémica equivalente
INAQOVI ha demostrado una exposición sistemática equivalente a la decitabina IV1.

Seguridad comprobada
INAQOVI tiene un perfil de seguridad tolerable y conocido, similar al de la decitabina IV1,4.

Tratamiento en casa
INAQOVI se puede tomar en casa1, reduciendo así la dependencia en hospitales12.

Eficacia contrastada
La decitabina IV ha demostrado una eficacia equivalente a la azacitidina2,3.

Reducción de la carga sanitaria
El tratamiento oral puede reducir la carga de los recursos sanitarios5.
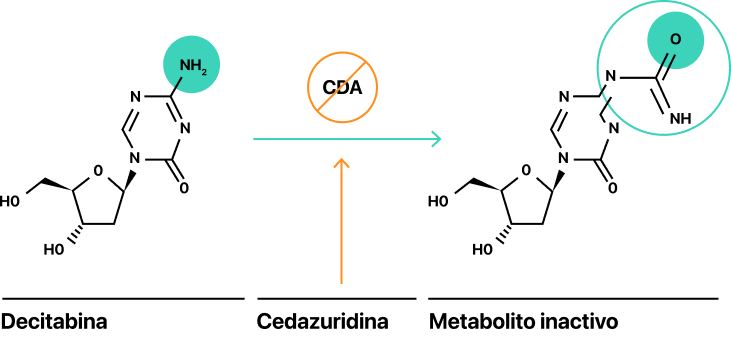
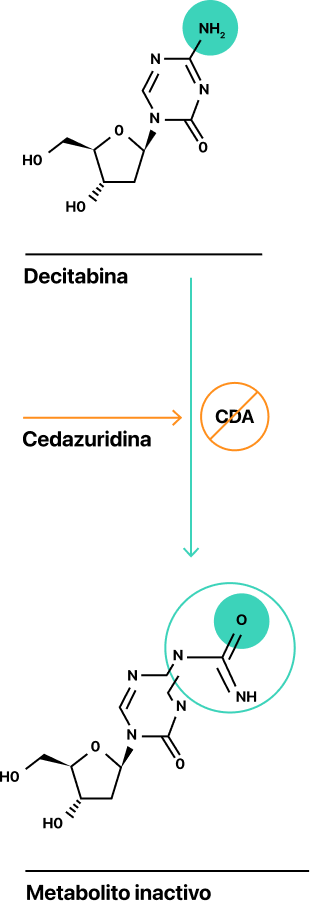
INAQOVI es una combinación a dosis fija del agente hipometilante decitabina (35mg) y la cedazuridina (100mg) inhibidora de la citidina desaminasa (CDA) que se administra vía oral1.
La biodisponibilidad oral de la decitabina es baja debido a la degradación en el intestino por la CDA1.
La cedazuridina es un inhibidor de la CDA que impide que la decitabina se descomponga en el intestino, mejorando su biodisponibilidad y aumentando su exposición sistémica1.
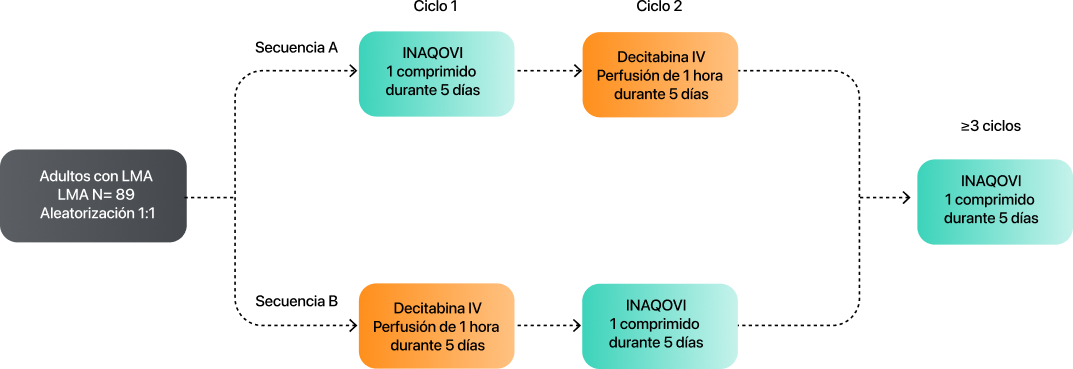
INAQOVI fue evaluado en un estudio de fase III (ASTX727-02-EU, NCT03306264) abierto, aleatorizado, de diseño cruzado, de 2 ciclos y 2 secuencias, que incluyó a pacientes adultos con LMA de novo o secundaria según los criterios de la Organización Mundial de la Salud (OMS), que no eran candidatos para la quimioterapia de inducción estándar7.
El estudio ASCERTAIN comparó la exposición a decitabina en pacientes tratados con INAQOVI oral y decitabina IV7.

89
pacientes randomizados (1:1) en dos sequencias de tratamiento
27
centros

9
países
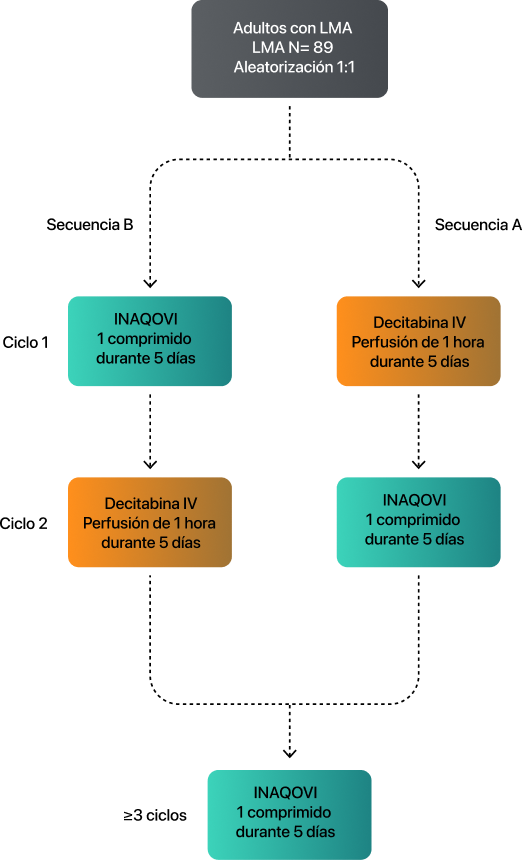
- Candidatos para decitabina intravenosa
- EF 0-1 de ECOG
- Esperanza de vida >3 meses
- Se permitió un ciclo previo del hipometilante
Variable primaria7
- Equivalencia total del AUC de decitabina durante 5 días (oral/IV IC del 90 % entre el 80% y el 125 %)
Variable secundaria7
- Eficacia: tasa de respuesta, independencia de transfusiones, duración de la respuesta, supervivencia global y sin acontecimientos
- Seguridad
- Máxima desmetilación de LINE-1
con LMA candidatos al tratamiento con decitabina.
de los 89 pacientes aleatorios, recibieron tratamiento.
de los 87 tratados, recibieron INAQOVI7
La mediana de duración del tratamiento fue de 4,5 meses (rango 0-7,8 meses)7. Participaron 27 centros de 9 países, entre ellos España, que contó con la aportación de 8 centros investigadores11.
Características demográficas y basales de la enfermedad7Edad (años) |
Fase III Inaqovi (N=89) |
Mediana (min, máx) |
78 (61,92) |
Sexo (%) |
|
Hombres |
54 (60,7) |
Mujeres |
35 (39,3) |
Puntuación de rendimiento ECOG (%) |
|
0 |
36 (40,4) |
1 |
53 (59,6) |
Categoría de la enfermedad (%) |
|
LMA de novo |
57 (64,0) |
LMA secundaria |
32 (36,0) |
SMD |
18 (20,2) |
Otro trastorno hematológico antecedente |
7 (7,9) |
LMA relacionada con el tratamiento |
7 (7,9) |
Tratamiento AHM previo (%) |
|
Azacitidina previa |
2 (2,2) |
Dependencia de transfusión (%) |
|
Dependencia de transfusión de GR |
37 (41,6) |
Dependencia de transfusión de plaquetas |
14 (15,7) |
Tabla 1: Adaptado de Geissler K et al.7
El estudio alcanzó su objetivo principal y demostró una exposición equivalente (AUC0-24 durante 5 días de decitabina) en ambos grupos de estudio7.
Todos los análisis de sensibilidad y de las variables farmacocinéticas secundarias del AUC confirmaron los resultados de la variable principal7.
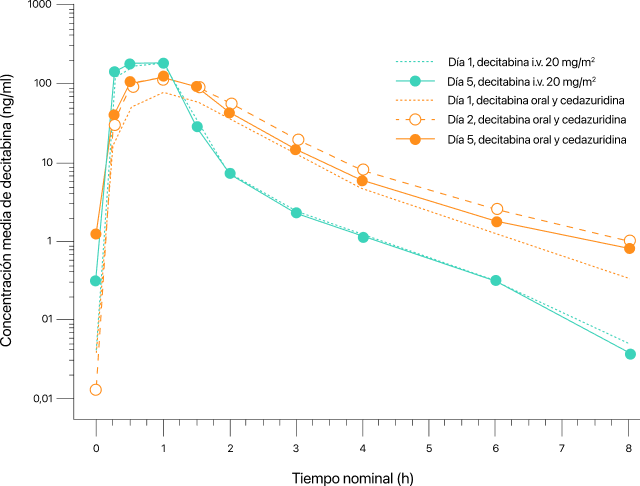
La relación de la media geométrica del AUC0-24h total de 5 días de decitabina entre INAQOVI y la decitabina IV fue del 100% para los pacientes con LMA
(IC del 90%, 91-109%)7
La desmetilación del gen LINE-1 es una medida global de la hipometilación inducida por los hipometilantes. El % máximo de desmetilación del gen LINE-1 fue similar entre INAQOVI y decitabina IV en los ciclos 1 y 2, lo que demuestra que ambos tratamientos producen efectos farmacodinámicos similares7.
mSG7 8,9 meses (IC del 95 %: 6,0-13,1)
mSSP7 6,1 meses (IC del 95 %: 4,8-8,7)
mSSA7 5,9 meses (IC del 95 %: 3,8-8,5)
Estudios con decitabina IV:
Ensayo DACO-16*
mSG 7,7 meses
(IC del 95%: 6,2 - 9,2)9
Ensayo DACO-17*
mSG 7,6 meses
(IC del 95%: 5,7 - 11,5)8
*DACO-016 y DACO-017 se refiere al nombre de los estudios pivotales de decitabina endovenosa
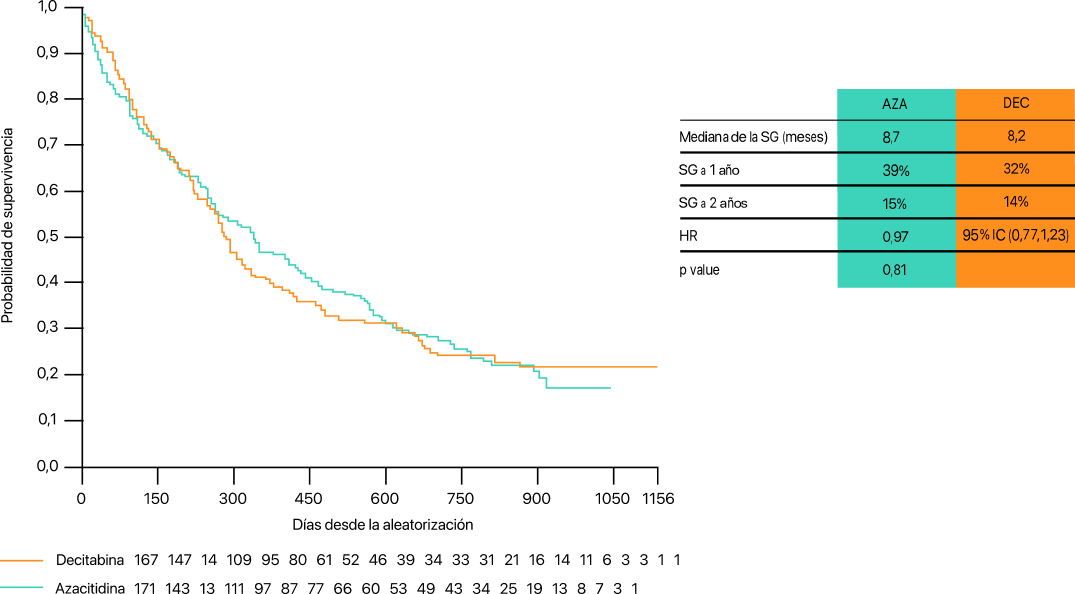
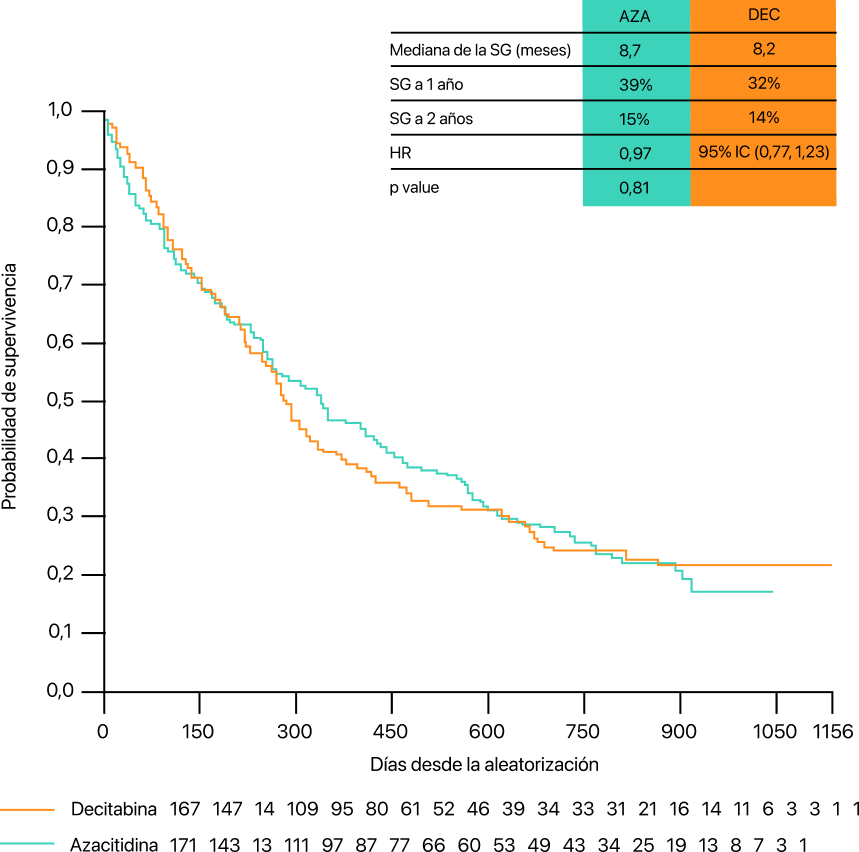
Probabilidad de supervivencia tras el tratamiento con azacitidina o decitabina10.
En el estudio ASCERTAIN, la mayoría de los AA de grado ≥ 3 estaban relacionados con la mielodepresión7.
Acontecimientos adversos relacionados con el tratamiento más comunes7
a. Los AA relacionados con el tratamiento, fueron codificados usando el Diccionario Médico para Actividades Regulatorias, versión 22.0, y están listados en orden descendente de incidencia en la población tratada con decitabina/cedazuridina (DEC-C) oral.
b. AA que ocurrieron en ≥ 15% de los pacientes.
| Pacientes, N (%) | Conjunto de eficacia (N=87) | DEC-C oral (N=80) |
|---|---|---|
≥1 AA Independientemente de su relación con el tratamientob |
86 (99) |
80 (100) |
Trombocitopenia |
50 (58) |
47 (59) |
Anemia |
45 (52) |
44 (55) |
Neutropenia |
28 (32) |
28 (35) |
Neutropenia febril |
26 (30) |
25 (31) |
Astenia |
22 (25) |
22 (28) |
Neumonía |
22 (25) |
19 (24) |
Pirexia (fiebre) |
19 (22) |
19 (24) |
Diarrea |
18 (21) |
18 (23) |
Náusea |
17 (20) |
17 (21) |
Edema periférico |
16 (18) |
16 (20) |
Estrenimiento |
17 (20) |
15 (19) |
Hipopotasemia (bajo potasio) |
15 (17) |
15 (19) |
Disminución del apetito |
12 (14) |
12 (15) |
≥1 grado ≥3 AA independientemente de su relación con el tratamiento |
52 (66) |
43 (55) |
Trombocitopenia |
43 (49) |
41 (51) |
Anemia |
33 (38) |
33 (41) |
Neutropenia |
26 (30) |
26 (32) |
Neutropenia febril |
24 (28) |
23 (29) |
Neumonía |
21 (24) |
18 (23) |
≥1 AA relacionados con el tratamientob |
60 (69) |
57 (71) |
Trombocitopenia |
27 (31) |
26 (33) |
Neutropenia |
20 (23) |
20 (25) |
Anemia |
17 (20) |
17 (21) |
Tabla 3. Adaptado de Geissler K et al.7
En pacientes con LMA, INAQOVI tiene potencial para ser una alternativa oral al estándar de tratamiento con decitabina IV7.
En la población de pacientes con LMA no candidatos a quimioterapia intensiva de inducción, el tratamiento con INAQOVI presenta:
- Equivalencia farmacocinética en el AUC a la decitabina IV a una dosis de 20 mg/m2 durante 5 días7.
- Actividad farmacodinámica similar a la decitabina IV7.
Tras 23,6 meses de seguimiento, los resultados muestran:
- Mediana de supervivencia global de 8,9 meses (IC 95% 6,0-13,1)7.
- Tasas de RC de 21,8% y Respuesta Compuesta (RC + RCi + RP) de 32,2%7.
- No hay nuevas señales de seguridad destacables7.

INAQOVI debe tragarse entero con agua, aproximadamente a la misma hora cada día1.

No deben ingerirse alimentos entre 2 horas antes y después de tomar INAQOVI, debido a la posible influencia sobre la eficacia1.

El tratamiento con INAQOVI debe continuar durante un mínimo de 4 ciclos hasta la progresión de la enfermedad o toxicidad inaceptable1.

Una respuesta completa o parcial puede tardar más de 4 ciclos1.
Antes del inicio y antes de cada ciclo, obtener los hemogramas completos, la bioquímica hepática y la creatinina sérica1.
AA Acontecimiento adverso
AUC Área bajo la curva
CDA Citidina desaminasa
ECOG Grupo de Oncologia Cooperativo del Este (Eastern Cooperative Oncology Group)
IC Intervalo de confianza
IV Intravenoso o por vía intravenosa
LMA Leucemia mieloide aguda
mSG Mediana de la supervivencia global
mSSA Mediana de la supervivencia sin acontecimientos
mSSP Mediana de la supervivencia sin progresión
SIC Quimioterapia de inducción estándar (standard induction chemotherapy)
RC Remisión Completa
RCi Remisión Completa con Recuperación Incompleta
RP Remisión Parcial
- Ficha técnica INAQOVI. Marzo de 2025.
- Zeidan AM et al. Prospective comparison of outcomes with azacitidine and decitabine in patients with AML ineligible for intensive chemotherapy. Blood. 2022;140(3):285-289.
- Ma J, et al. Comparison Between Decitabine and Azacitidine for Patients With Acute Myeloid Leukemia and Higher-Risk Myelodysplastic Syndrome: A Systematic Review and Network Meta-Analysis. Frontiers in Pharmacology. 2021;12.701690.
- Dacogen 50 mg powder for concentrate for solution for infusion. Summary of Product Characteristics. February 2022.
- Oakley C et al. Safe practice and nursing care of patients receiving oral anti-cancer medicines: a position statement from UKONS. Ecancermedicalscience. 2010;4:177.
- Adaptado de Geissler K et al. Abstract 1538. Poster presentado en ASH Annual Meeting, San Diego, CA Dec, 9-11,2023
- Geissler K, Koristek Z, Bernal del Castillo T, et al. Oral decitabine/cedazuridine versus intravenous decitabine for acute myeloid leukaemia: A randomised, crossover, registration, pharmacokinetics study. Br J Haematol. 2024;00:1–12
- Santini V et al. The Clinical Value of Decitabine Monotherapy in Patients with Acute Myeloid Leukemia. Advances in Therapy. 2022;39(4):1474-1488.
- Kantarjian HM et al. Multicenter, Randomized, Open-Label, Phase III Trial of Decitabine Versus Patient Choice, With Physician Advice, of Either Supportive Care or Low-Dose Cytarabine for the Treatment of Older Patients With Newly Diagnosed Acute Myeloid Leukemia. Journal of Clinical Oncology. 2012;30(21):2670-2677.
- Zeidan AM et al. Prospective comparison of outcomes with azacitidine and decitabine in patients with AML ineligible for intensive chemotherapy. Blood. 2022;140(3):285-289.
- EPAR INAQOVI 2023.
- Di Constanzo A, et al. Clinicoecon Outcomes Res. 2025;17:171-187.